腫瘍センター
大腸がん
はじめに
大腸がんは早期がんと進行がんに大別されます。早期がんは粘膜下層と呼ばれる大腸表面直下の部分までに留まるものであり、大部分は無症状です。一方、進行がんはさらに深部までもぐったがんで、当然早期がんより大きいものが多いのですが、必ずしも血便などの症状をきたすわけではありません。従って、大腸がんをできるだけ早期に発見するためには、無症状の時期に大腸の検査をすることが重要となります。
大腸がんの診断においては、主に内視鏡検査が用いられています。大腸内視鏡検査は、内視鏡機器の進歩と熟達した内視鏡医が育成されたことにより普及しています。その結果、がんのみならず前癌状態の良性病変、あるいは一部ががん化した病変などを解像度の高い内視鏡を用いて診断することが可能となりました。一方、CT、MRI、 PETなどの画像解像度の向上も著しく、これらの方法は大腸がんの広がりを診断するために必要不可欠な検査法となっています。
大腸がんの治療方針は、がんの広がりと深さによって大きく異なります。特に、深さは大変重要なポイントで、前述の粘膜下層のうち比較的浅い部分までに留まるものは内視鏡的治療で根治できますが、深い部分まで入り込んだ場合はリンパ節転移の可能性があり、外科的治療が第一選択となります。内視鏡治療としてはポリペクトミーや内視鏡的粘膜切除術、内視鏡的粘膜下層剥離術などの手技が用いられ、外科的治療としては腹腔鏡下大腸切除術と開腹術があります。一方、より進行した大腸がんに対しては、有効な抗がん剤が開発されていますし、放射線療法を用いることもあります。久留米大学病院では、これらの治療法を単独、あるいは組み合わせて患者さんに提供することでより良い大腸がんの治療を心がけています
大腸がんを取り扱う診療科は消化器内科、消化器外科、放射線科、がん集学治療センター、放射線治療センターや緩和ケアセンターと多岐にわたります。以下に当院における大腸がんの診断・治療の現状を紹介します。また、当院における大腸がん診療に関するデータを示し、患者さんからの質問が多い疑問にお答え致します。
診断
1.大腸内視鏡検査
内視鏡スコープを肛門から挿入して、全大腸(直腸、S状結腸、下行結腸、横行結腸、上行結腸、盲腸)を観察する検査です。検査を受ける前に多量の下剤で大腸を洗浄してきれいにする必要があります。検査に対して苦痛が強い方には、希望により鎮静剤を使用して苦痛の軽減を図ります。病変(がん、ポリープなど)を発見した場合または病変が疑われる場合には、組織を一部採取(生検)して顕微鏡で細胞の観察を行い、病変の種類および悪性か良性かの診断を行います(病理診断)。最近では病変の表面構造を拡大して観察することのできる拡大内視鏡が普及してきており、病変に特殊な染色を施した後に表面模様を観察することで良・悪性の判断や、悪性である際は、その深さを推測することが可能になってきています(拡大内視鏡検査)。また内視鏡から病変に対して超音波(エコー)を直接あてることでがんの深さやリンパ節転移の有無を診断することができます(超音波内視鏡検査)。2.注腸造影検査
肛門から検査用の管を挿入し、そこからバリウムと空気を注入して体の向きを変えながらX線写真を撮る検査です。検査を受ける前には大腸をきれいにする必要があり、検査前日は検査食を食べて、夜に下剤を服用します。検査後にもバリウムが腸管内に残らないように下剤の服用を行います。この検査で大腸がんの位置や大きさを客観的に診断できます。また大腸がんのある場所では粘膜模様やひだの異常、腸管壁の変形を認め、その所見から病変の深さを診断します。3.CT検査/MRI検査
CT検査(コンピュータ断層撮影法)は、身体に多方向からX線を照射して得られた情報をコンピュータで処理し身体の断面像を描出する検査で、MRI 検査(核磁気共鳴画像法)は磁気の力を利用して身体の断面像などを描出することのできる検査です。造影剤を使用することで、そのコントラストにより診断能が上昇しますが、強い腎障害のある方や造影剤にアレルギーのある方は基本的に使用できません。CTや MRIでは大腸がんの広がりや転移の有無をみますが、それぞれにメリットとデメリットがあり、大腸がんの発生部位やその広がり方でCTとMRIのどちらの検査が必要か(もしくは両方とも)の判断を行います。4.腹部超音波検査
超音波(エコー)検査は、体内にある臓器などに超音波が当たって跳ね返ってきた信号が映像になって映し出される検査です。主として肝臓への転移の診断に用いられます。特に、最近開発されたソナゾイド(ペルフルブタンの微小気泡)造影剤を用いた超音波検査では小病変の存在診断能および質的診断能の向上がみられています。5.PET検査
がん細胞は分裂が盛んで、エネルギー源となるブドウ糖を正常な細胞よりも何倍も取り込むという性質を持っています。PET(陽電子放射断層撮影法)はその性質を利用した検査で、陽電子を放出するブドウ糖に近い成分(FDG)を体内に注射し、体内での薬剤の分布を画像化します。FDGが異常に集まる場所を見つけることで、がんの発生部位の特定や転移の診断に用います。6.腫瘍マーカー
がんの種類によって多くのマーカーがあり、大腸がんではCEAやCA19-9 が一般的です。ただし腫瘍マーカーの異常だけでは、大腸がんの有無や進行度合いの判断はできません。大腸がんが存在しても腫瘍マーカーが上昇しないこともあります。しかし腫瘍マーカーは定期的に測定して経過を追うことにより、がんに対する治療効果の判定やがんの再発の有無などの一つの指標となります。内視鏡治療
早期大腸がんに対する内視鏡治療として主なものに、内視鏡的ポリペクトミーと内視鏡的粘膜切除術(EMR)があります。内視鏡的ポリペクトミーは、茎やくびれを有したポリープ状のがんに対して、スネアと呼ばれるリング状の電気メスで病変の根もとを縛って焼き切る方法です。しかし、早期大腸がんの中には隆起の丈が低いものや陥凹した形態を呈するものも多く認め、容易にスネアで病変を縛ることができないものも存在します。このような病変に対してはEMRが行われます。 EMRは1980年代に日本で開発された治療法で、病変の下に薬液を注射して擬似的に病変を隆起させた後に、スネアで病変を縛って焼き切る方法です。この方法は安全かつ簡便であること、比較的短時間で終了できることにより、早期大腸がんの標準的な内視鏡治療法として全国に普及しています。しかし、EMRは大きな病変や内視鏡治療後に再発した病変を切除することができないという欠点がありました。そこで、この欠点を補う治療法として近年、内視鏡的粘膜下層剥離術(ESD)という方法が行われています。ESDはEMRをベースとして開発された早期大腸がんに対する治療法で、病変周囲や病変の下を特殊な電気メスを用いて切開して剥がしていく方法です(下図)。ESDは、EMRによる切除が困難な病変でも切除することができるため、がんの取り残しによる再発が少なく、なおかつ切除した組織の詳細な病理組織学的検索が可能となることで、外科的治療を含めた追加治療の必要性に関して十分な検討ができます。ただし、大腸の壁は非常に薄く、粘膜層および粘膜下層を切開して剥がしとっていくESDには内視鏡の繊細な操作が必要であり、EMR よりも高度な技術が要求されます。当院では、日本消化器病学会や日本消化器内視鏡学会より認定を受けた指導医や専門医を中心として、最新の内視鏡機器を用いてポリペクトミーやEMR、ESDを行っています。また、同時に、次世代を担う若い医師へのトレーニングも行い、内視鏡治療の技術向上のため日々修練を積んでいます。
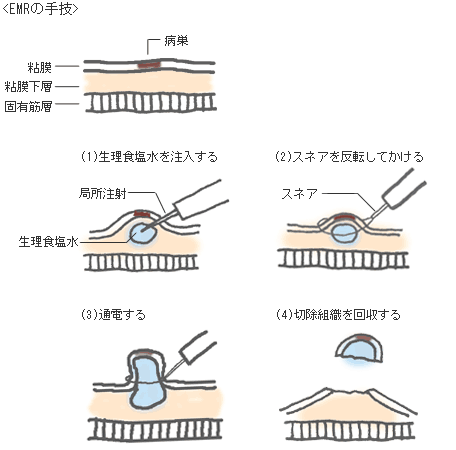
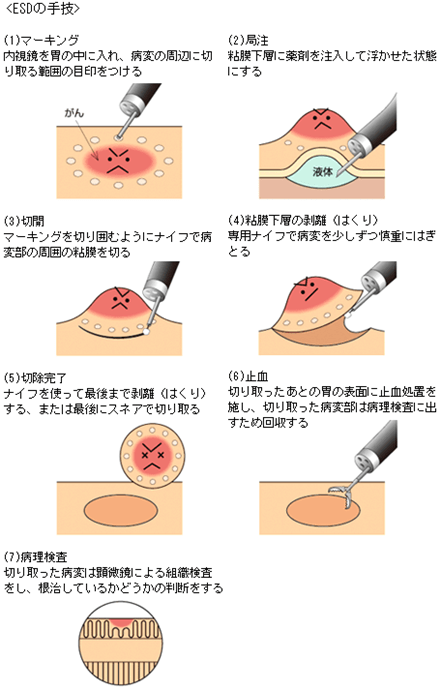
外科治療
1.腹腔鏡手術
腹腔鏡手術とはビデオカメラでおなかの中を見ながら行う手術のことです。従来の開腹手術では皮膚を10〜20 cm切開していましたが、ポートという5〜12 mm径の管を約5個刺して、炭酸ガスで腹部を膨らませて行います。切除に必要な腸管の授動とリンパ節郭清を腹腔内で行ったのち、皮膚に小切開(3〜6 cm)を追加して、病変を体外に出して切除し、腸管をつなぎます。
大腸疾患に対しては、日本では1992 年に開始されました。特徴として、傷が小さいため術後の痛みや患者負担が少なく、回復が早いことが挙げられます。当初は良性疾患や早期がんに限定されていましたが、徐々に適応が拡大され、2010年の大腸癌治療ガイドラインでは早期がんの規制がはずれ、「がんの部位や進行度などの患者要因のほかに、術者の経験、技量を考慮して適応を決めるべきである」と改訂されました。当院でも進行がんに対する腹腔鏡下手術の割合は年々増加しています。勿論手術で最も大切なのは「根治性(=きちんととれること、再発率が低いこと)」ですが、欧米の報告では進行がんに腹腔鏡手術を行っても開腹手術と再発率に差はないとの結果になっており、ステージⅡ/Ⅲの大腸がんを対象とした日本の臨床試験の結果は、全生存期間の腹腔鏡下手術の開腹手術に対する非劣性は証明されませんでした。しかし、全生存期間も無再発生存期間も2群でほぼ同等であったことから、「熟練した施設では腹腔鏡下手術も一選択肢になり得る」と考えられています。また、腹腔鏡下手術は開腹手術で見るよりもより近接して拡大視野で行うため、微細な血管・神経を認識しながら行え、出血量も少なくなっています。但し、腹腔鏡手術は特殊な器械を使用することもあって、手術費用は10万円以上高い設定になっています。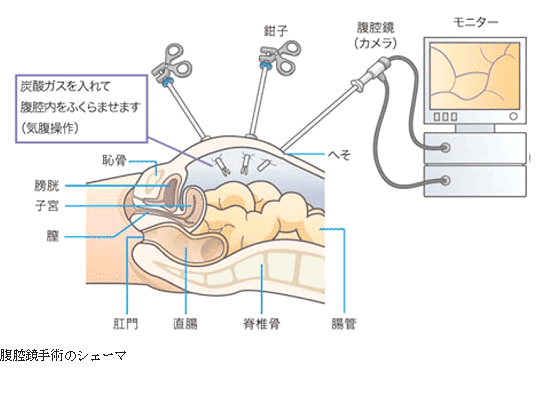
2.開腹手術
従来より行われている腹部皮膚を10〜20 cm切開して開腹し、直視下に手術を行う方法です。腹腔鏡を用いた鏡視下手術でも、第3群までのリンパ節郭清(D3)を含む定型手術が可能となってきましたが、がんの部位や進行具合い、他の臓器の合併切除の必要性といった腫瘍側の要因、および過去の開腹歴などといった手術をうける人の要因によって開腹手術の方が「手術でがんを取り除く」という目的が達成できる状況もあります。例えば、骨盤内臓全摘術は男性では直腸、膀胱、前立腺、精嚢、女性では直腸、子宮、膣、膀胱を切除し、さらに内腸骨動静脈および周囲のリンパ節を切除郭清し、尿の通り道の変更を伴う大腸がんの手術の中では最も侵襲の大きな手術ですが、当院では安全性を重視し開腹手術の適応としています。
3.括約筋切除肛門温存術
従来、肛門括約筋(肛門を意識的に締める外肛門括約筋および無意識的に締める内肛門括約筋)を切除することは、術後の肛門機能が保てないとの理由から、肛門にかかるあるいはきわめて近い直腸がん・肛門管がんでは肛門を含めた下部直腸の広範な合併切除、すなはち直腸切断術が一般的な術式として定着していました。しかし、肛門内外でのがんの浸潤や広がりはこれまで考えられていたほど高度ではなく、理論的には肛門の一部を切除することで根治性が得られること、内肛門括約筋を切除してもある程度の肛門機能が保たれることが明らかになりました。久留米大学では全国に先駆けて括約筋切除肛門温存術を研究・開発および実施してまいりました。本術式は開腹でも腹腔鏡下でも施行可能で、症例の進行度によって適応を決定しています。
4.高齢化と「がん」
がんの発生頻度は年齢に相関して増加します。厚生労働省の平成25年の年齢別平均余命データでは、80歳が男性8.6年、女性11.5年、85歳が男性6.1年、女性8.2年と長く、単に高齢だけの理由でがん治療を行わないことは少なくなることが予測されます。したがって今後、国内人口の高齢化に伴い高齢でがん治療を必要とする人の割合はさらに増えていくことが予想されます。腹腔鏡手術、開腹手術いずれにおいても手術手技の標準化と周術期管理の進歩によって合併症の頻度は数%に抑えられ、より安全に手術が受けられるようになってきています。従来は手術が困難であるとされた多くの合併症を伴う患者さんでも、チーム医療により手術可能となっています。
5.病期別の生存率
大腸がんの5年生存率は、結腸がん・直腸がんの順でステージ0:94.8・ 92.9%、ステージI:90.6・89.3%、ステージⅡ:83.6%・76.4%、ステージⅢa:76.1・64.7%、ステージⅢb: 62. 1・47. 1%、ステージⅣ:14. 3・11.1%と報告されています(大腸癌研究会・大腸癌全国登録 1991〜1994年度症例)。以上のように進行度が進むにつれ、生存率は低下します。近年開発された、分子標的薬と呼ばれる薬が日本でも使えるようになりました。これによって外科的切除だけでは治療困難であった大腸がんの治療は大きく前進しました。肝転移は大腸がんの特徴の一つですが、かつて大腸がん肝転移患者さんの治療は緩和的な化学療法のみで、生存期間は極めて短いものでした。しかし現在では、効果的な化学療法と分子標的薬によって、大腸がん治療は劇的に変わりました。
化学療法
1.切除不能の進行・再発大腸がんに対する化学療法
切除不能の進行・再発大腸がんに対する化学療法に関しては、新規の抗がん剤が本邦でも多数用いられるようになり、治療成績は向上してきました。現在は、オキサリプラチン、イリノテカン、5-FU、ロイコボリンをそれぞれ組 み 合 わ せ た、FOLFOX 療 法 と FOLFIRI療法が主に行われています。どちらも薬剤を約48時間かけて静脈内投与する方法ですが、中心静脈注射ポートと、飲料用ペットボトル大のインフュージョンポンプと呼ばれる器具を用いることで外来通院での治療が可能となっています。これらの治療に加え、中心静脈ポートなどの器具を用いず、外来での点滴と、5-FU、ロイコボリンにかわる内服薬(カペシタビンまたはS-1)の組み合わせによる治療も可能で、オキサリプラチンとカペシタビンによるXELOX療法やイリノテカンとS-1によるIRIS療法などが行われています。これらの治療法は効果の面でほぼ同等と考えられており、順序を問わず 5-FU(またはカペシタビン、S-1)、オキサリプラチン、イリノテカンの3剤で十分に治療することが大切であると考えられています。当院でも、この原則に従って治療を計画しています。 また、新しい世代の薬剤として2種類4剤の分子標的抗がん剤、ベバシズマブ、セツキシマブ、パニツムマブ、ラムシルマブが進行・再発大腸がんの治療に用いられるようになり、治療成績の向上に寄与しています。ベバシズマブとラムシルマブは、腫瘍細胞に酸素や栄養を送る血管の成長を妨げて腫瘍の増殖を抑える薬剤です。セツキシマブ、パニツムマブは、ともに腫瘍細胞の表面にある増殖刺激の入り口をブロックして腫瘍増殖を抑える薬剤です。これらの分子標的抗がん剤と、上記のFOLFOX療法、FOLFIRI療法などを組み合わせることでさらに治療成績が向上することも知られており、当院でも積極的にこれらの治療法を行なっています。
これらの抗がん剤により治療成績が向上したことで、この項の最初に述べたように、近年、当初切除困難と判断された転移巣が切除可能となるケースが増えてきています(コンバージョン:治療方針の転換)。
さらに最近、上述の標準的化学療法の効果が無くなった後(3次治療以降)の治療として2種類の新薬が開発されました。マルチキナーゼ阻害剤分子標的薬レゴラフェニブとトリフルリジン・チピラシル(TAS-102)というヌクレオシド系経口剤で、それぞれ単独で使用します。上述の標準治療のような腫瘍縮小効果は認められませんが、生存期間の延長効果があり、サルベージ治療として有効性が示されています。
2.術前後(周術期)補助化学療法
臨床病期Ⅲ期の大腸がんに対しては、腫瘍を全て取り除く根治的な手術の後に一定期間の化学療法を行なうこと(術後補助化学療法)で再発する可能性をより低く抑えられることがわかっており、当院でも術後状態に問題がなければ補助化学療法をお勧めしています。5-FUとロイコボリン、あるいは内服薬のUFTとロイコボリン、またはカペシタビンを用いることが一般的です。また、上記のオキサリプラチンを含む治療を行なうこともあり、その有効性も証明されています。また、状況によっては臨床病期Ⅱ期でも補助療法を考慮することがあり、こちらも臨床試験でその有効性を検討しています。大腸がんのうち直腸がんでは根治切除後に局所再発が問題となることがあり、欧米では術前に化学放射線療法が広く行われています。日本では手術成績が良好なため直腸がんの術前補助化学放射線療法は一般的ではありませんが、化学療法の成績向上をうけてさらに良好な治療成績を目指し、臨床病期 Ⅲ期の直腸がんに対する術前化学療法を行う臨床試験が実施されています。
大腸がんでは、臨床病期Ⅳ期で遠隔転移巣があっても、完全切除が可能な場合には切除を考慮することが勧められています。切除可能な肝転移の場合には、肝切除術前および術後に3ヶ月ずつ補助化学療法(FOLFOX療法)を行うことが有効であると報告されています。また、手術後6ヶ月間の補助化学療法も有効な可能性が考えられています。当院でもこのように手術と化学療法を組み合わせた治療を行なっており、病巣の広がりや合併症の有無などを総合的に考慮し、患者さんごとに治療計画を提案しています。肺転移など、肝転移以外の転移巣切除については抗がん剤治療との組み合わせによる治療の成績は未報告ですが、肝転移切除に準じて患者さんごとに治療計画を検討しています。
3.化学療法の個別化
大腸がんの化学療法では、いくつかの治療薬について、効果や副作用を投与前に予想できるものがあります。近年の研究により、セツキシマブ、パニツムマブに関しては、がん細胞の RAS遺伝子検査を行うことで、治療前から効果の期待できない患者さんを診断することが可能となりました。これにより、無効な抗がん剤を使って副作用のみを被ることを減らし、治療費を抑えることにもつながっています。また、イリノテカンの投与前に UGT1A1遺伝子多型検査を行うことで副作用ハイリスク群を事前に診断することも可能となっており、化学療法施行に際し臓器障害などの危険因子を有する患者さんを中心に検査を行なっています。放射線療法
1.術前放射線治療
単独放射線治療が行われることもありますが、最近は化学放射線療法が行われています。術前に化学放射線療法を行うことで、局所制御率(局所の再発を防ぐ)・肛門括約筋温存(肛門が残る)率の向上が期待できます。2.術後放射線治療
術後放射線治療によって、局所再発率の減少が期待できます。術後は腸管の癒着などがあるため、放射線治療の有害事象として、下痢を含めた消化器症状の発生に注意が必要です。3.手術不可能例・再発例に対する放射線治療
手術不可能例や骨盤内再発病変に対して放射線治療が行われます。周囲臓器への浸潤が疑われ根治的切除困難が予想される場合、もしくは並存疾患のため手術不可能な場合には放射線治療が用いられます。また、骨盤内再発病変には小線源を使用した組織内照射も行われることがあります。4.治療計画
治療計画は、CT画像を基にして行われます。GTV(gross tumor volume)と呼ばれる指標は原発巣とリンパ節腫大を合わせた範囲です。 CTV(clinical target volume)は、原発巣に加えて2-3 cmを加えた範囲、リンパ節腫大に0.5−1 cmを加えた範囲、所属リンパ節(直腸傍リンパ節・内腸骨リンパ節・閉鎖リンパ節・仙骨前リンパ節)を含めた範囲です。より進行した直腸がんでは、さらに外腸骨リンパ節領域を含めて照射します。 PTV(planning target volume)とはCTVにさらに1 cmを加えた範囲です。PTVを含む範囲に前後2方向からの照射や、左右2方向に後1門を加えた3方向からの照射、あるいは前後左右4方向からの門照射が行われます。5.線量
術前照射は40〜50Gyを20〜28回に分けて一週間当たり4〜5回、術後照射は50Gyを25〜28回に分けて一週間当たり5回照射するのが標準的です。術後に病変が残存する場合には50Gy の時点で極力腸に直接照射することを避けながら、総線量60Gy程度まで追加します。当院では、直腸がんに対して60Gyを投与する場合には、まず 40Gyを全骨盤腔に投与し、その後、照射野を病変部とその周囲の十分な範囲を加えた領域に絞って20Gy追加照射を行っています。6.緩和放射線治療
骨転移による疼痛や神経症状を緩和する目的で放射線治療が行われます。7.急性期有害事象
下痢・膀胱炎・肛門痛・会陰部皮膚炎などがあげられます。8.晩期有害事象
頻便・瘻孔形成・腸閉塞・潰瘍形成などが挙げられます。重粒子線治療
院内がん登録情報
担当部署と専門医
| 部門 | 担当医 | 外来診療 |
|---|---|---|
| 消化器外科 | 赤木 由人 | 月・木・金曜日午前 |
| 藤田 文彦 | 水曜日午前・午後 | |
| 吉田 武史 | 金曜日午前・午後 | |
| 合志 健一 | 月曜日午前・午後 | |
| 藤吉 健司 | ||
| 吉田 直裕 | ||
| 仕垣 隆浩 | ||
| 古賀 史記 | ||
| 川本 祐輔 | ||
| 野口 尭志 | ||
| 菊池 麻亜子 | ||
|
消化器内科
|
||
| 放射線科 (放射線腫瘍センター) |
||
|
がん集学治療センター
(化学療法) |
三輪 啓介 | 月曜日午前 水曜日午前・午後 木曜日午前 |
| 長主 祥子 | 月曜日午前・午後 金曜日午前 |
|
| 執行 ひろな | ||
| 病理部 | 秋葉 純 |
患者さんご紹介の際には「紹介予約センター」をご利用ください。
予約専用フリーダイヤルTEL:0800-200-4897、FAX:0800-200-9489
紹介予約センター直通TEL:0942-27-5673、FAX:0942-31-7897





